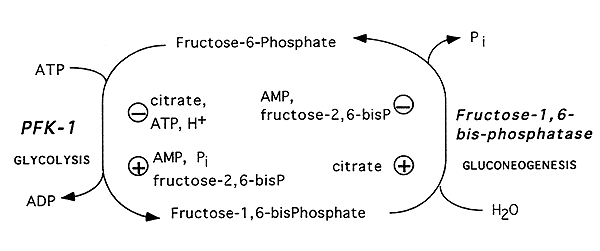
La fosfofruttochinasi 2 (anche detta fosfofruttocinasi 2 o PFK-2 o Enzima Tandem) è un enzima bifunzionale deputato alla regolazione della quantità di fruttosio 2,6-bifosfato e fruttosio 6-fosfato nell'epatocita.
Struttura e Funzione
Due domini regolano la concentrazione di fruttosio 2,6-bifosfato: uno fosforila il fruttosio 6-fosfato a fruttosio 2,6-bifosfato, e l'altro defosforila il fruttosio 2,6-bifosfato a fruttosio 6-fosfato.
La formazione del fruttosio 2,6-bifosfato è catalizzata dalla fosfofruttochinasi 2 (PFK2). Il fruttosio 6-fosfato si forma per idrolisi del fruttosio 2,6-bifosfato, catalizzata dalla fruttosio bifosfatasi 2 (FBPasi2).
Sia la PFK2, sia la FBPasi2 sono presenti in una singola catena polipeptidica di 55 kD.
Le attività della PFK2 e della FBPasi2 sono reciprocamente controllate per fosforilazione di un singolo residuo di serina.
Regolazione
Entrambi i domini sono presenti su una singola catena polipeptidica di 55 kD.
Le attività della PFK2 e della FBPasi2 sono controllate per fosforilazione di un singolo residuo di serina, per esempio dalla via di PKA, attivata dalla segnalazione glucagonica, mentre l'opposta defosforilazione è operata per esempio da PP1, attivata dalla segnalazione insulinica.
In questo modo non sono mai attivi entrambi i domini, ma sempre o l'uno o l'altro, per evitare un ciclo futile.
Quando il livello di glucosio è basso, nel sangue viene rilasciato glucagone, la cui via di segnalazione cellulare coinvolge le proeine G della membrana cellulare e terminerà con la produzione di cAMP nella cellula.
La proteina chinasi A, attivata dagli alti livelli di cAMP nella cellula va a fosforilare l'enzima bifunzionale, attivando la FBPasi2 e inibendo la PFK2.
L'enzima quindi inizierà a ridurre il livello intracellulare di fruttosio 2,6-bisfosfato.
Siccome il fruttosio 2,6-bisfosfato stimola la PFK1, la diminuzione della sua concentrazione porta all'inibizione della glicolisi. Il suo calo stimola invece FBPasi-1, quindi la gluconeogenesi.
Al contrario, quando il glucosio è alto, come dopo un pasto, prevale la via di segnalazione mediata dall'insulina. Questa, attrava PP1, che rimuove il gruppo fosforico rimosso dall'enzima bifunzionale, che quindi attiva il dominio chinasico e inattiva quello fosfatasico, consumando F2,6BP.
Così si ferma la gluconeogenesi, non più necessaria, e invece si stimola il consumo di glucosio tramite la glicolisi.
Esiste un isozima della PFK-2 presente a livello cardiaco, il cui dominio chinasico è stimolato dall'adrenalina, che quindi alza F2,6-bisfosfato nel miocardiocita, accelerandone la glicolisi.